肺纤维化(Pulmonary fibrosis, PF),特别是特发性肺纤维化,是一种肺部组织被瘢痕替代、导致功能丧失的疾病。尽管其发病机制未完全明确,但近年来在分子病理机制上有所突破,推动了尼达尼布和吡非尼酮等药物的上市。这些治疗方法能够在一定程度上减缓病情发展,但它们通常伴有不良反应,且无法实现根本治愈。为了深入研究肺纤维化的发病机制和开发新的治疗方法,建立可靠的体外模型至关重要[1]。
TGF-β是一种多功能细胞因子,参与调节细胞增殖、分化和凋亡。TGF-β与细胞受体结合后,激活Smad蛋白并调控基因,促进纤维化,还能通过非Smad途径(如MAPK)加速这一过程。在肺纤维化过程中,TGF-β通路被异常激活,使细胞外基质过度沉积,形成肺疤痕。在特发性肺纤维化中,TGF-β通路的异常激活是纤维化进展的关键因素之一[2]。近年来,利用TGF-β诱导肺相关细胞系和肺类器官纤维化模型,已成为研究肺纤维化的热门方法。
提问:为什么选择TGF-β诱导肺纤维化?
TGF-β建模 vs 传统模型:肺纤维化研究中的优势对比
|
对比维度 |
TGF-β建模 |
传统模型(如博莱霉素、放射线、基因编辑) |
|
机制特异性 |
精准靶向纤维化核心通路(TGF-β/Smad信号通路),避免炎症干扰 |
非特异性炎症反应[3](博莱霉素)或单一基因功能研究(基因编辑) |
|
实验可控性 |
TGF-β浓度、作用时间可精确调控,体外48小时即可诱导稳定EMT表型[4] |
剂量和时间难以精确控制,表型不稳定 |
|
实验周期 |
造模周期短(<1周) |
周期长(博莱霉素:2-4周;放射线:>4周) |
|
多通路交互模拟 |
激活Smad3、Col1a1等多靶点,模拟纤维化多通路交互[5,6] |
基因编辑模型仅聚焦单一基因,难以模拟多通路交互 |
|
临床关联性 |
与COVID-19后纤维化、IPF等临床病理高度关联,动态模拟局部或弥漫性纤维化[7] |
难以模拟病毒性纤维化(如COVID-19后纤维化) |
|
数据可重复性 |
数据重复性高(>95%),结果一致性强 |
数据波动大,重复性较低(如博莱霉素模型的炎症干扰) |
|
操作难度 |
操作简单,无需复杂设备 |
操作复杂(如放射线模型需特殊设备,基因编辑模型技术门槛高) |
|
成本效益 |
试剂成本低,实验效率高 |
成本高(如基因编辑模型的构建与验证费用) |
|
转化价值 |
支持抗纤维化药物筛选与机制研究,临床前验证潜力大(如Cilengitide抑制剂)[8] |
转化价值有限,难以直接应用于药物开发 |
综上,TGF-β造模因其机制靶向性、操作可控性及结果一致性,成为肺纤维化研究的优选工具,尤其适用于信号通路解析和抗纤维化药物开发。
TGF-β诱导肺纤维化实验流程
在体外纤维化造模的实验中,通常会选择对TGF-β信号高度敏感的肺泡上皮细胞(如A549细胞系)或人胚肺成纤维细胞(HELF)。推荐采用2–10 ng/mL的TGF-β1进行处理24–72小时,根据细胞响应程度可以适当调整浓度和处理时间,并对模型进行鉴定和分析。
鉴定
(1)细胞形态:可以观察到细胞从典型的鹅卵石状上皮形态向梭形间质形态的转变;
(2)基因水平:使用实时荧光定量PCR(RT-qPCR)技术可检测到上皮标志基因E-cadherin的表达降低,以及胶原合成相关基因Collagen I/III(Col1a1/Col3a1)、α-SMA、Vimentin、结缔组织生长因子CTGF的表达上调;
(3)蛋白水平:通过WB或ELISA对TGF-β信号通路的下游效应蛋白如磷酸化Smad3(p-Smad3)、Collagen I、α-SMA以及炎症相关因子IL-6、TNF-α进行定量分析[9]。为了评估胶原沉积和细胞外基质(ECM)重塑,可采用羟脯氨酸(HYP)比色法测定胶原含量,并通过Masson三色染色或Sirius Red染色技术对胶原纤维进行组织化学染色[10]。
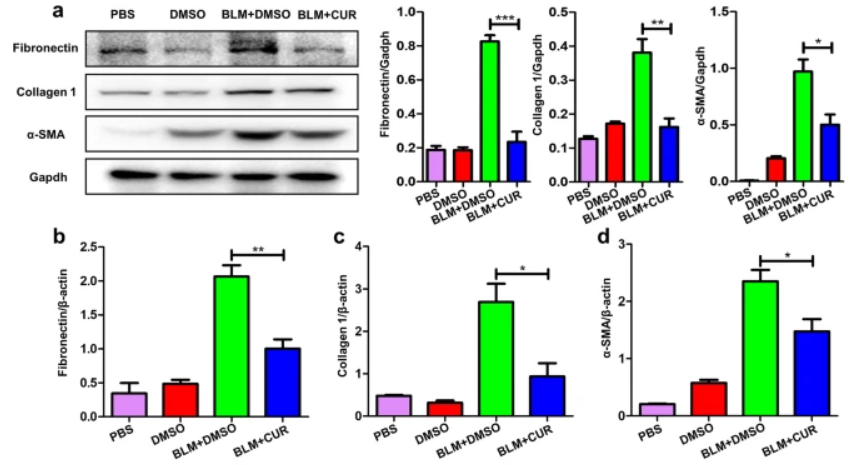
体外纤维化模型鉴定指标:Fibronectin、Collagen I、α-SMA[9]
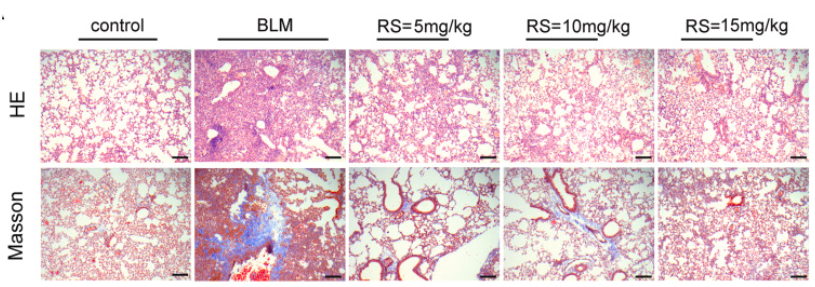
使用 H&E 染色和 Masson 三色染色评估不同实验组的组织病理学变化和胶原蛋白沉积[10]
(4)功能学验证:通过Transwell渗透实验评估细胞侵袭和迁移能力的变化,以及通过胶原凝胶收缩实验来证实肌成纤维细胞的收缩活性[11]。
(5)信号通路分析:通过Western blotting检测p-Smad3与Smad3的比值来确认TGF-β介导的经典Smad信号通路的激活状态,并探究丝裂原活化蛋白激酶(MAPK)途径中的p38 MAPK和细胞外信号调节激酶(ERK)的磷酸化水平,以揭示非经典信号通路的作用。
近岸蛋白提供低内毒素,高纯度,高活性,高批间一致性的重组TGF-β1蛋白,该产品荣获CiteAb引用前100,让您的纤维化建模之旅更稳定顺利!
产品数据
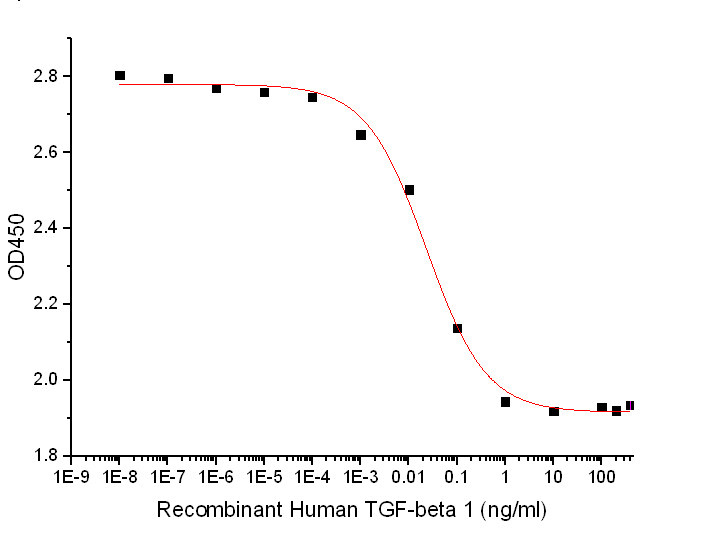
Measured by its ability to inhibit the IL-4-dependent proliferation of TF‑1 human erythroleukemic cells. The ED50 for this effect is 4-40 pg/ml
下期预告:肝纤维化建模
参考文献
[1]Koudstaal, T., Funke-Chambour, M., Kreuter, M., Molyneaux, P. L., & Wijsenbeek, M. S. (2023). Pulmonary fibrosis: from pathogenesis to clinical decision-making. Trends in molecular medicine.
[2]Ong, C. H., Tham, C. L., Harith, H. H., Firdaus, N., & Israf, D. A. (2021). TGF-β-induced fibrosis: A review on the underlying mechanism and potential therapeutic strategies. European journal of pharmacology, 911, 174510.
[3]Yue, X., Shan, B., & A. Lasky, J. (2010). TGF-β: titan of lung fibrogenesis. Current enzyme inhibition, 6(2), 67-77.
[4]Kasai, H., Allen, J. T., Mason, R. M., Kamimura, T., & Zhang, Z. (2005). TGF-β1 induces human alveolar epithelial to mesenchymal cell transition (EMT). Respiratory research, 6, 1-15.
[5]Yang, W., Li, Y., Shi, F., & Liu, H. (2023). Human lung organoid: Models for respiratory biology and diseases. Developmental Biology, 494, 26-34.
[6]Wei, P., Xie, Y., &Tu, Y. (2019). Transforming growth factor (TGF)-β1-induced miR-133a inhibits myofibroblast differentiation and pulmonary fibrosis. Cell death & disease 10, no. 9: 670.
[7]Gaikwad, A. V., Lu, W., Dey, S., Bhattarai, P., Haug, G., Larby, J., & Sohal, S. S. (2023). Endothelial-to-mesenchymal transition: a precursor to pulmonary arterial remodelling in patients with idiopathic pulmonary fibrosis. ERJ open research, 9(2).
[8]Yi, M., Yuan, Y., Ma, L., Li, L., Qin, W., Wu, B., & Liu, B. (2024). Inhibition of TGFβ1 activation prevents radiation‐induced lung fibrosis. Clinical and Translational Medicine, 14(1), e1546.
[9]Liu, P., Miao, K., Zhang, L., Mou, Y., Xu, Y., & Wang, Y. (2020). Curdione ameliorates bleomycin-induced pulmonary fibrosis by repressing TGF-β-induced fibroblast to myofibroblast differentiation. Respiratory research, 21, 1-10.
[10]Li, S., Xu, A., Li, Y., Tan, C., La Regina, G., Silvestri, R., & Qi, W. (2021). RS4651 suppresses lung fibroblast activation via the TGF-β1/SMAD signalling pathway. European Journal of Pharmacology, 903, 174135.
[11]Yamanishi, C., Robinson, S., & Takayama, S. (2019). Biofabrication of phenotypic pulmonary fibrosis assays. Biofabrication, 11(3), 032005.
